Une nouvelle validation de la capacité de la société à assurer une télésurveillance continue des signes vitaux des patients à l’hôpital et à domicile.
FREMONT, Californie, 28 juillet 2021 /PRNewswire/ — LifeSignals Inc. a annoncé aujourd’hui que la plateforme de télésurveillance multiparamétrique LifeSignals LX1550 a obtenu l’approbation 510 (k) de la FDA pour des dispositifs de classe II. Cette approbation fait suite à la récente obtention du marquage CE et constitue une nouvelle validation de la volonté de LifeSignals de créer des plateformes sans fil innovantes pouvant être utilisées par les cliniciens pour la collecte continue des données physiologiques des patients à domicile et dans les établissements de santé.
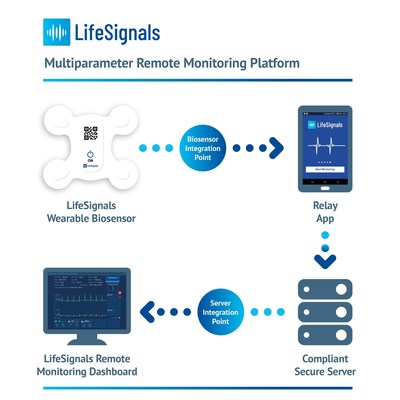

Au cœur de la plateforme se trouve un biocapteur multiparamétrique portable à usage unique qui enregistre les données relatives à l’électrocardiographie (ECG à deux canaux), la fréquence cardiaque, la fréquence respiratoire, la température de la peau et la posture du corps pendant cinq jours. Les données physiologiques cryptées peuvent ensuite être transmises avec une grande fiabilité depuis le biocapteur, via une application relais, vers une plateforme sécurisée basée sur le cloud. Les cliniciens et les prestataires de soins peuvent accéder au tableau de bord de télésurveillance basé sur le cloud pour consulter les données physiologiques des patients et gérer les paramètres d’alerte.
La plateforme de télésurveillance est conçue pour permettre aux entreprises des technologies de la santé d’améliorer rapidement leurs portefeuilles de produits et de services afin de fournir une surveillance des signes vitaux au plus grand nombre de patients possible, où qu’ils se trouvent. L’application relais et le tableau de bord sont conviviaux pour les développeurs grâce aux API du kit de développement de logiciels prêts à être déployés et sont adaptés à une mise en œuvre à grande échelle.
« La pandémie de COVID-19 a fait tomber les barrières à la télésurveillance des patients au niveau mondial et je suis fier de la façon dont l’équipe de LifeSignals a réagi pour développer la plateforme en si peu de temps », déclare Surendar Magar, fondateur et PDG. « Cette approbation 510 (k) de la FDA marque une autre étape majeure dans le développement et la mission de l’entreprise. La plateforme a été mise en œuvre avec succès dans les hôpitaux pour le suivi des patients atteints de COVID-19 en Inde et est en cours de déploiement en Europe, au Royaume-Uni, à Singapour et aux Philippines. Notre objectif est maintenant d’introduire rapidement la télésurveillance des signes vitaux à faible coût auprès des entreprises américaines des technologies de la santé qui souhaitent étoffer leurs services et améliorer les soins aux patients. »
Photo – https://mma.prnewswire.com/media/1582121/LifeSignals.jpg

