La nouvelle autorisation de la FDA témoigne de l’utilité du i:X dans la détection fiable des bactéries cliniquement significatives qui compromettent la cicatrisation des plaies
TORONTO, 30 juin 2022 /PRNewswire/ — MolecuLight Inc., le leader de l’imagerie par fluorescence au point d’intervention pour la détection en temps réel des plaies contenant des charges bactériennes élevées, annonce qu’elle a reçu une extension de son autorisation 510(k) de la FDA pour la capacité du dispositif d’imagerie MolecuLight i:X® à détecter l’emplacement des charges bactériennes élevées (>104 CFU/g) dans les plaies. L’étiquetage élargi inclut également la capacité du dispositif à identifier les zones de plaies contenant davantage d’espèces bactériennes, y compris les pathogènes cibles clés qui intéressent le CDC et qui sont des causes majeures de résistance aux antimicrobiens1. Les espèces détectables comprennent les bactéries de type Gram négatif et Gram positif, les aérobies et les anaérobies. Cet étiquetage élargi est basé sur une analyse statistique rétrospective détaillée de plus de 350 patients.

« Nous nous félicitons de la nouvelle autorisation de la FDA pour la capacité de MolecuLight à déterminer l’emplacement des charges bactériennes élevées dans les plaies, en plus de la capacité à identifier les régions avec plus d’espèces bactériennes d’intérêt », a déclaré Anil Amlani, PDG de MolecuLight. « Les cliniciens du monde entier utilisent le dispositif MolecuLight pour visualiser les régions présentant des charges bactériennes cliniquement significatives et comportant davantage d’espèces préoccupantes. Avec des informations au point d’intervention sur la charge bactérienne et sa localisation grâce à l’utilisation d’un dispositif MolecuLight, les cliniciens peuvent agir immédiatement pour adapter en conséquence leurs stratégies de nettoyage, de débridement, d’antimicrobiens ainsi que leurs traitements ».
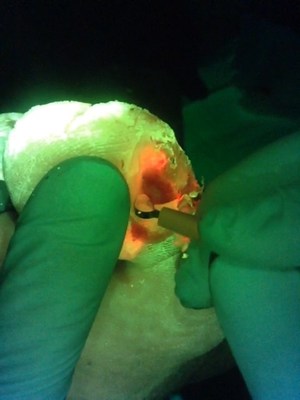
Cette vidéo (avec l’aimable autorisation de Rose Raizman) illustre l’importance de visualiser l’emplacement d’une charge bactérienne élevée dans une plaie. Dans ce scénario, le clinicien utilise MolecuLight i:X pour éclairer sa prise de décision et cibler l’hygiène de la plaie sur les zones de fluorescence rouge. Des régions rouges, indiquant que la plaie contient des niveaux cliniquement significatifs (>104 CFU/g) de charge bactérienne, sont clairement visibles sur l’ulcère du pied diabétique du patient (voir image).
En outre, la FDA a également reconnu la capacité de MolecuLight à visualiser les régions contenant des espèces bactériennes préoccupantes au point d’intervention. Le dispositif MolecuLight peut être utilisé pour permettre des biopsies tissulaires guidées par fluorescence dans ces régions afin de détecter un plus grand nombre d’agents pathogènes d’intérêt (définis par le CDC comme présentant un risque accru de développer une résistance aux antibiotiques) par rapport aux biopsies guidées par les soins standard. Le CDC a identifié la résistance aux antibiotiques comme « l’un des plus grands défis mondiaux de santé publique de notre époque »1. Les stratégies de lutte contre la résistance aux antibiotiques comprennent l’endiguement des menaces émergentes par une détection précoce et une réponse agressive, ainsi que l’amélioration de l’utilisation appropriée des antibiotiques par le biais de programmes de gérance antimicrobienne. L’utilisation étendue d’outils de diagnostic, comme MolecuLight, pour améliorer la précision et la rapidité de la détection des agents pathogènes a été préconisée pour aider à améliorer la sélection appropriée des antibiotiques et réduire l’utilisation inutile d’antibiotiques1.
MolecuLight a été le premier à recevoir l’autorisation de novo de la FDA pour sa plateforme d’imagerie MolecuLight i:X et a ensuite reçu trois autres autorisations 510(k) de la FDA pour ce dispositif.
|
Référence : |
|
|
1 CDC. Antibiotic Resistance Threats in the United States, 2019. Atlanta, GA: US Department of Health and Human Services, CDC;2019 |

À propos de MolecuLight Inc.
MolecuLight Inc. est une société privée d’imagerie médicale qui a développé et commercialisé sa technologie exclusive de plateforme d’imagerie fluorescente sur de multiples marchés cliniques. La suite d’appareils commercialisés par MolecuLight, notamment les systèmes d’imagerie par fluorescence MolecuLight i:X® et DX™ et leurs accessoires, fournissent des dispositifs d’imagerie portatifs au point d’intervention pour le marché mondial du traitement des plaies pour la détection et la localisation en temps réel d’une charge bactérienne élevée dans les plaies et pour la mesure numérique des plaies. Les procédures MolecuLight effectuées aux États-Unis peuvent bénéficier d’une voie de remboursement disponible comprenant deux codes CPT® pour le travail du médecin afin d’effectuer « l’imagerie par fluorescence pour la présence, l’emplacement et la charge bactérienne » et le paiement de l’établissement pour les Services de Consultations Externes des Hôpitaux (SCEH) et les Centres Chirurgicaux Ambulatoires (CCA) par le biais d’une Classification de Paiement Ambulatoire (CPA). L’entreprise commercialise également sa technologie unique de plateforme d’imagerie par fluorescence pour d’autres marchés présentant des besoins non satisfaits à l’échelle mondiale, notamment la sécurité alimentaire, les cosmétiques grand public et d’autres marchés industriels clés.
Image : Télécharger à : https://moleculight.box.com/s/ax8758gz0f8amouhcjjvs4xzkfa9vofo
Vidéo : https://youtu.be/HKOCGBlIQj4
Rob Sandler, directeur marketing, MolecuLight Inc., Tél. : +1.647.362.4684, rsandler@moleculight.com

